1 影响RTO处理效率的因素
使用RTO工艺处理VOCs,其核心技术来源于化学反应工程理论,在反应物浓度(Concentration)确定的前提下,基于“E”重点控制“3T”,即通过控制反应温度(Temperature)、紊流度(Turbulence)、反应停留时间(Residence Time)达到目标净化效率(Efficiency)。
(1)反应温度
反应温度是使用热氧化法处理VOCs中最为关键的技术参数,在非催化环境下,需要的反应温度为760~1200℃。需要的处理效率越高,反应温度就越高。而选择反应温度,关键是看废气组成中各组分的自燃点(AIT),AIT越高,其自燃就需要从环境中获得更多的能量,只有高过AIT足够的温度,才有可能通过热氧化法焚毁。
需要说明的是,对于还原硫化合物,如硫化氢、甲基硫醇和二甲基硫化氢则只需要650℃即可。
(2)紊流度
雷诺准数(Re)是反映流体流态(紊流度)的无量纲准数,当流体Re>4000时,即为处于湍流状态。对于VOCs氧化反应而言,为了获得较好的紊流度,反应器内的Re宜大于10000。
流速依赖于反应器内径,内径越小,流速越快。在组成相对稳定的前提下,雷诺准数中的各个参数之间构成了多变量的关联,速度、密度和粘度取决于流体温度,流体温度越高,密度越小、粘度越低,则流速越快,Re的计算要根据实际数值进行计算。当然,因VOCs废气浓度一般较低,反应引起的组成变化可忽略不计。根据经验,在工况条件下,气体在燃烧室内的空塔气速应保持在6m/s以上可获得理想的紊流度。
(3)反应停留时间
在工程应用中,化学反应停留时间与反应器设备造价、运行能耗存在直接关系。在工程上,VOCs氧化反应停留时间通常按照0.75~2.0s进行设计,停留时间越长,反应越充分,处理效率越高,当然,投资和能耗越高,反之亦然。假如设定处理效率为99.99%,在必须达到的反应温度前提下,每增加1.0s停留时间,仅能够降低反应温度10~35℃,因此,对于氧化法处理VOCs,国家发布的相关标准或技术规程往往规定了反应时间和反应温度,是经过大量工程实践得出的经验值。
因此,在治理目标明确的前提下,RTO反应器的设计受多因素限制,并直接影响工程化效果。
2 RTO中反应停留时间、反应温度与反应转化率之间的关系
在“3T”同时影响RTO设计、运行的情况下,RTO中反应停留时间、反应温度和转化率之间也互相影响。参考《DESIGN of THERMAL OXIDATION SYSTEMS for VOLATILE ORGANIC COMPOUNDS》,RTO处理效率与反应温度、停留时间的关系如表2-1所示。
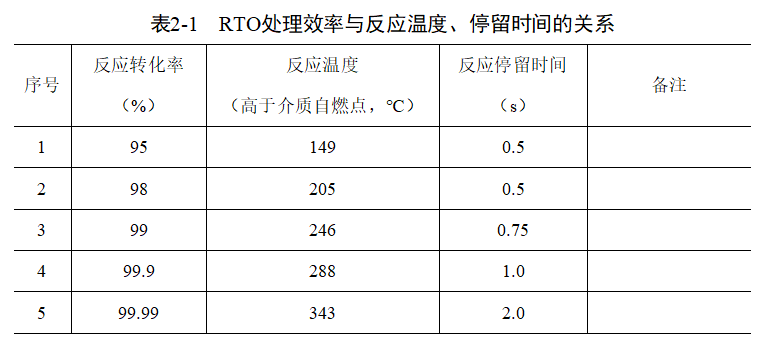
根据表2-1,可以看出,当处理效率(反应转化率)达到98%时,需要反应温度超过介质自燃点205℃,同时反应停留时间≥0.5s;当处理效率达到99%时,需要反应温度超过介质自燃点246℃,同时反应停留时间≥0.75s。反应物的转化率同时满足时间和温度时方能达到处理效果,但是在温度不变,而反应停留时间延长,同样能够达到更高的转化率。
有机物发生完全氧化反应(燃烧)时,多为二级反应,RTO反应器作为平推流等温反应器,反应动力学方程如下:

以环戊二烯为例,环戊二烯的自燃点为640℃,如果达到99%的处理效率,则其反应温度为(640+246=886)℃,同时反应停留时间至少为0.75s。假设以表2-1中转化率为98%时的反应温度,即(640+205=845)℃作为反应温度,如果达到99%的处理效率,其反应停留时间为0.5×(1/0.98-1)/(1/0.99-1)=1.01s,即在845℃时,停留时间超过1.01s,也可达到99%的转化率。
由于温度是影响RTO氧化反应的主要因素,实践证明,温度降低幅度通常不超过56℃,因此在采用表2-1中的数据进行反应温度与停留时间耦合计算时,对于温度的选取,不应超出该范围。同时,《蓄热燃烧法工业有机废气治理工程技术规范》(HJ 1093-2020)中要求 “6.3.3.3 废气在燃烧室的停留时间一般不宜低于0.75s”。在技术规范允许的范围内,可以进行理论层面的探讨,根据表2-1和(式2-2),表2-1中使用相邻小一级转化率的反应温度换算如表2-2所示。
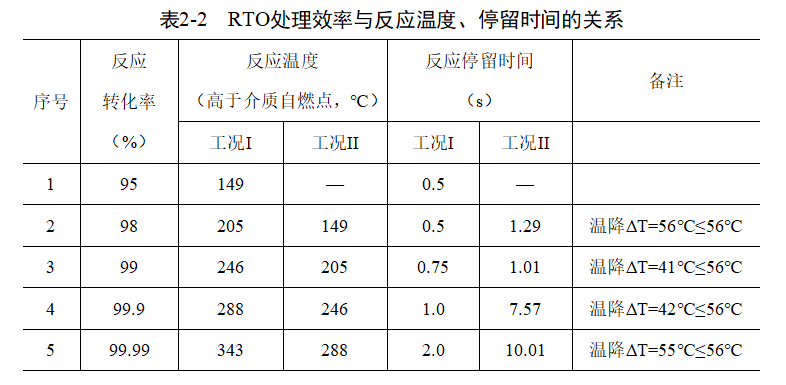
同理,对于同一温度下,反应停留时间与反应转化率也可以直接推导。如当反应温度为(AIT+288)℃时,反应转化率与停留时间的关系如表2-3所示。
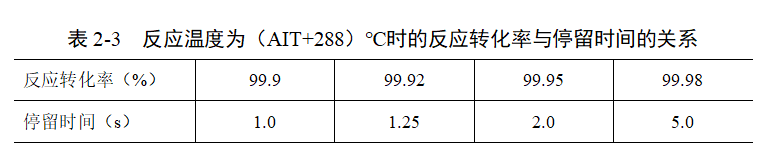
每提高一定幅度的转化率增加的反应停留时间与温度密不可分,如(AIT+288)℃和(AIT+246)℃下转化率分别与停留时间的关系如图2-1所示。
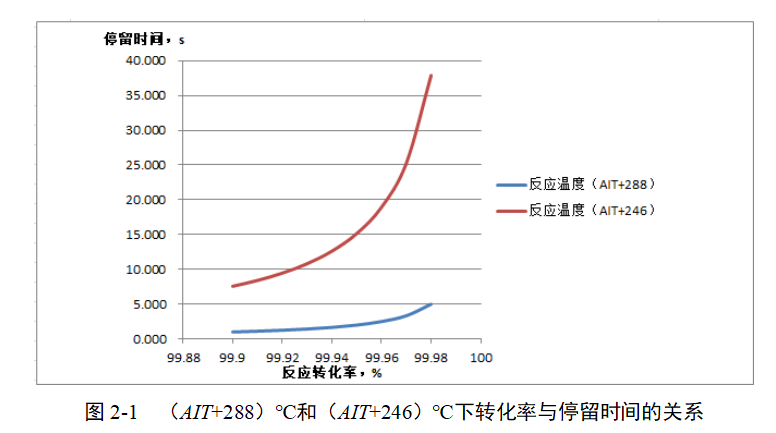
从图2-1中可知,提高同样幅度的转化率,低温反应需要更多的停留时间。因为反应速率常数是温度的函数,如阿伦尼乌斯方程所示:

式中,
k-反应速率常数;
A-指前因子(或频率因子),与单位时间内反应物分子的碰撞次数、碰撞取向等因素有关,对于特定反应,可以近似看作常数。其单位与k相同;
e-自然对数的底数,2.718;
Eₐ-活化能,kJ/mol;
R-理想气体常数,8.314 J/(mol·K);
T-热力学温度,K。
将(式2-3)变形后,可得:
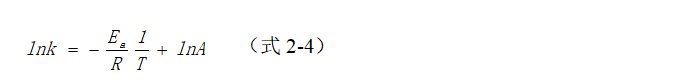
使用(式2-4),通过实验测定不同温度(T)下的速率常数(k),以 lnk对 1/T 作图,可以得到一条直线。从直线的斜率可以计算出反应的活化能Eₐ,从截距可以求出指前因子A。因斜率带有负号(-),温度(T)越高,-1/RT 值越大,lnk越大,所以,在RTO中发生的氧化反应才能够呈现出如图2-1中的趋势。同理,如果使用催化氧化工艺治理VOCs,因在催化剂的作用下,活化能Eₐ降低,同样的反应则需要比热力氧化更低的温度。
3 小结
本文仅提供一种工程化简算方法,仅供参考。使用RTO治理VOCs,其反应温度、停留时间通过计算虽然可以大致估算出其取值范围,但是反应器的结构设计对反应器中的流态也产生重要影响。因此,在工程应用中,应在理论计算的基础上,参考大量成熟的工程经验进行多次迭代设计,方能获得较好的工程化效果。
青岛西子环保研究院有限公司
二零二五年 九月


